- Chrome — что это за программа и нужна ли она на телефоне?
- Chrome — основные возможности
- Chrome — нужна ли эта программа на телефоне?
- СТРУКТУРА
- СВОЙСТВА
- ЗАПАСЫ И ДОБЫЧА
- Структура металла
- Свойства и характеристики
- Категории
- Хромирование
- Химические свойства
- Характерные степени окисления
- Простое вещество
- Соединения Cr(+2)
- Соединения Cr(+3)
- Применение
Поскольку сырье, добываемое вышеуказанными методами, насыщено примесями, а потребителям нужен чистый хром, для его извлечения из добытой руды используются различные физико-химические методы.
Chrome — что это за программа и нужна ли она на телефоне?
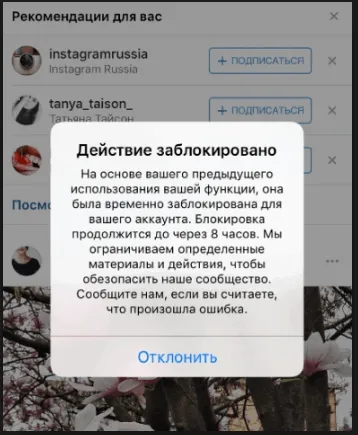
Здравствуйте друзья, сегодня у нас телефонная тема, а точнее — я расскажу о Chrome, что это такое и нужен ли он на вашем телефоне. Может быть, вам нужно удалить программу?
Браузер, другими словами, приложение для просмотра веб-страниц — интернета.
Это одна из самых популярных в мире программ для просмотра веб-страниц. сайты, видео, YouTube, онлайн-фильмы и т.д.
Chrome — это как окно в Интернет.
Браузер был создан компанией Google. Это самый популярный браузер как на ПК, так и на смартфонах.
Помимо Chrome, существуют и другие браузеры, такие как Opera и UC Browser. Они не плохие, но и не очень популярные.
Средняя оценка браузера составляет 4,3 (данные Google Play).

Посмотрите на общее количество пользователей, которые поставили ему оценку — более 21 миллиона! Мы даже не знаем, есть ли более популярная программа, чем Chrome, возможно, MicrosoftOffice.
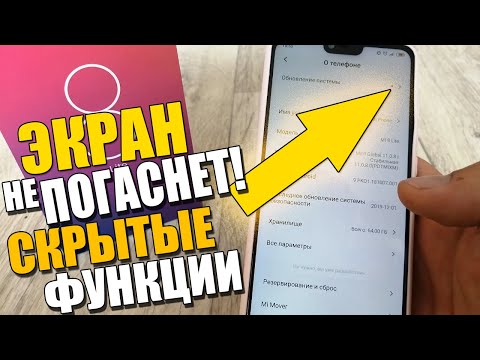
На самом деле, посмотрите, как выглядит Chrome.

Есть даже темная тема оформления:.
Chrome — основные возможности
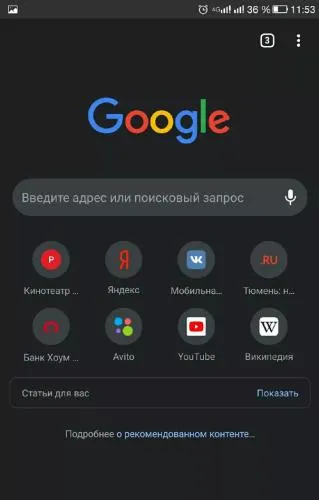
Браузер предлагает персонализированные новости, быстрые ссылки на любимые сайты, загружаемые файлы, встроенный Google Search и Google Translate (который может переводить сайты на русский язык). Ваши избранные сайты и выбранный контент (статьи для вас) будут выглядеть следующим образом
Ускорить интернет? Да, Chrome может сжимать данные (текст, изображения и даже видео) без ущерба для качества. В результате страницы загружаются быстрее и потребляют меньше трафика.
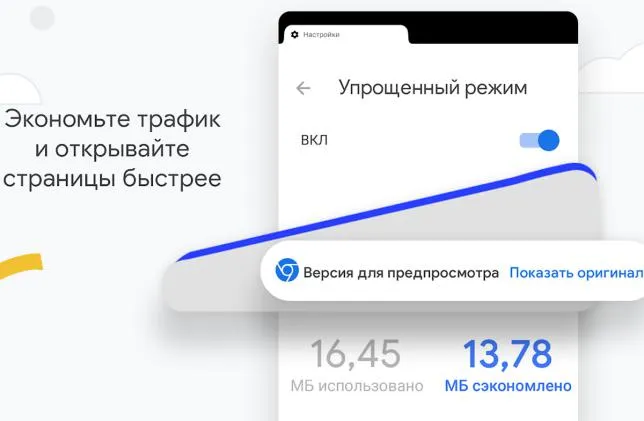
Это особенно важно, если у вас медленное GPRS-соединение.
Контент (видео, изображения и даже целые веб-сайты) может быть загружен.
Все загрузки сохраняются на специальной вкладке.
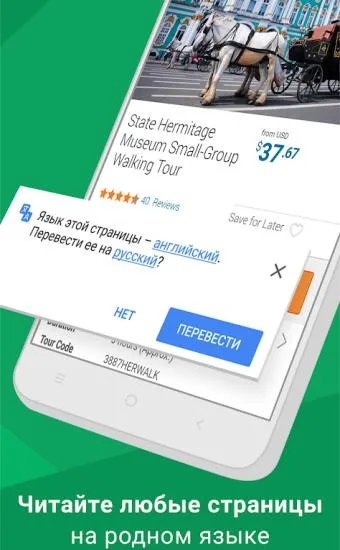
Сайт на иностранном языке? Нет проблем — Chrome предлагает следующие переводы
Присутствует безопасный просмотр — браузер предупредит вас, если вы откроете небезопасный веб-сайт или загрузите подозрительный файл.

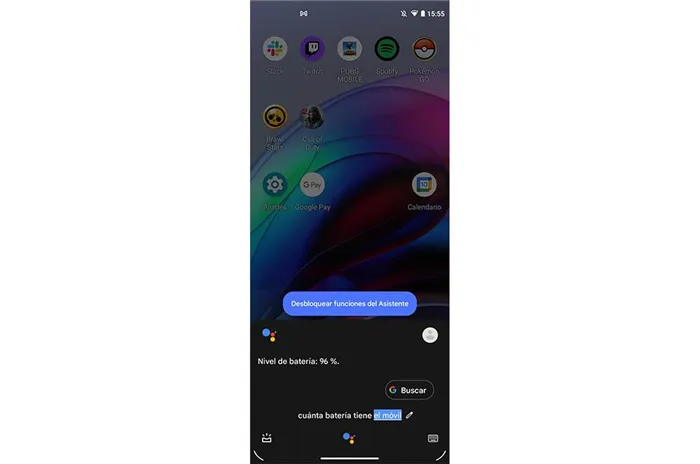
Голосовое управление — просто нажмите специальную кнопку и скажите, что вы хотите найти, и Chrome найдет это автоматически. Вы также можете, если я не ошибаюсь, сказать, например, погоду в Москве — и браузер может ответить в голосовом режиме.
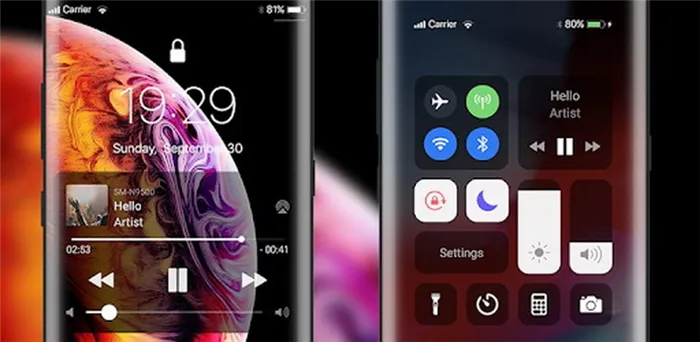
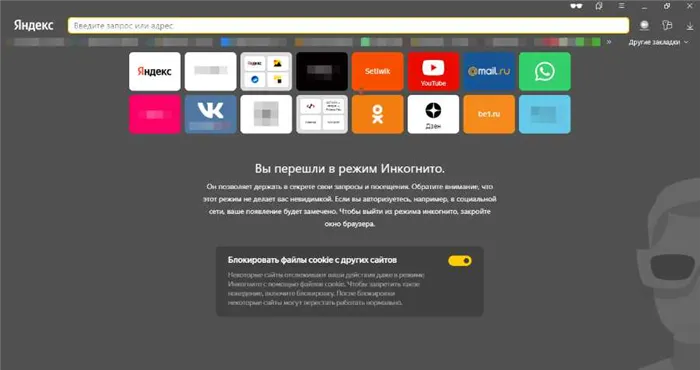
Имеется функция инкогнито. С ним все сайты, которые вы посещаете, не оставляют следов в браузере. Это означает, что они не будут появляться на заднем плане или в других местах.
Откройте режим инкогнито, выбрав вкладку Новое инкогнито в главном меню.
Синхронизация — когда вы заходите в свой аккаунт Google в браузере, все закладки, пароли и настройки синхронизируются (т.е. хранятся в облаке).
Например, если вы купите новый смартфон, откроете Chrome, введете имя пользователя и пароль, все данные со старого смартфона (закладки, пароли и т.д.) появятся на новом смартфоне.
Chrome — нужна ли эта программа на телефоне?
В принципе, сейчас легче ответить на этот вопрос.
- Да, вы можете удалить. Если это вообще возможно, может быть Chrome — системное приложение. Но без браузера вы сможете просматривать интернет только при условии что у вас установлен другой браузер, например Опера, Мозилла, UC Browser.
- Chrome на сегодняшний день пожалуй лучший браузер, быстрый и удобный, непросто так ведь он самый популярный, в том числе и на ПК.
- Браузер сделан компанией Google, а это, что не говори — значит стабильность и безглючность. Поэтому мое мнение — удалять Chrome не имеет никакого смысла.
Потребители часто не привыкли к хромированным изделиям, но они не привыкли к предметам, покрытым тонким слоем металла. Ослепительный блеск таких покрытий привлекателен сам по себе, но они имеют и чисто практическое значение. Хром устойчив к коррозии и помогает защитить сплавы и металлы от ржавчины.
СТРУКТУРА

Кристаллическая структура хрома.
В зависимости от типа химической связи хром, как и все металлы, имеет сетку металлических типов. Это означает, что в узлах решетки находятся атомы металла. В зависимости от пространственной симметрии — кубический, центр объема A = 0,28839 нм.Особенность хрома в том, что его природные свойства внезапно меняются примерно до 37 °C. Кристаллическая решетка металла состоит из его ионов и подвижных электронов. Аналогично, у хрома в его основном состоянии есть электроны. При температуре 1830°C это может быть преобразовано в модификацию решетки в центре грани a = 3,69 Å.
СВОЙСТВА

Твердость хрома составляет 9 единиц по шкале MOHS. Это один из самых твердых чистых металлов (уступает ириллию, бериллию, вольфраму и небесным телам). Очень чистый хром может работать очень хорошо. Он фиксируется в воздухе благодаря своей пассивности. По этой же причине он не реагирует с сульфатом и азотной кислотой. Он сгорает при 2000°C с образованием зеленого оксида (III) CR2o3Обладает амфибийными свойствами. При нагревании он вступает в реакцию со многими неметаллами, часто образуя карбиды, ноздри, пирит и нитриды. Хром образует многочисленные соединения с различной степенью окисления, в основном +2, +3 и +6. Хром обладает всеми свойствами, характерными для металлов. Он подходит для термических и электрических процессов и обладает блеском, характерным для большинства металлов. Он одновременно антимагнитен и парамагнитен, т.е. при 39°C он переходит из парамагнитного состояния в антимагнитное (точка NEEL).
ЗАПАСЫ И ДОБЫЧА

Самые крупные месторождения хрома находятся в Южной Африке (первое место в мире), Казахстане, России, Зимбабве и на Мадагаскаре. Месторождения также обнаружены в Турции, Индии, Армении, Бразилии и на Филиппинах. Основные российские горнорудные месторождения расположены на Урале (Донское и Сарановское). Общий запас хромовой руды в Казахстане превышает 350 млн тонн (второе место в мире). Хром появляется в основном в виде Fe — железного хрома (CRO2)2 (Железо-хромит). Железо добывается путем восстановления в электропечи с помощью кокса (углерода). Для получения чистого хрома проводятся следующие реакции: 1) карбонат натрия с карбонатом натрия (SODA) на воздухе — 2) растворение натрий-хрома и отделение от оксида железа — 3) кристаллизация с раствором дихромата, который превращает хром в бихромовую кислоту вместе с подкислением 4) чистый оксид получается восстановлением био полученный восстановлением натрия — 5) получают алюминиевый хром. Вода. Кислота.
Хром — довольно распространенный тяжелый металл, по сути, голубовато-белого цвета. Его химический цвет отличается, отсюда и название хром, которое переводится с греческого на русский как «цвет».
Структура металла
Кристалл хрома имеет кубическую сетку с центром объема A = 0,28845 нм. При температуре 1830 C изменения могут быть внесены в кубическую сетку с центральной поверхностью.
При температуре +38 C регистрируется фазовый переход второго вида, и объем увеличивается. Кристаллическая решетка вещества остается неизменной, но его магнитные свойства совершенно иные. При этой температуре Нейл Пойнт, Хром проявляет антимантичные свойства. Это означает, что вещество практически невозможно намагнитить. Выше точки Нила металл становится обычно парамагнитным. Это означает, что он обладает магнитными свойствами в присутствии магнитного поля.
Свойства и характеристики
При нормальных условиях металл очень инертен — как из-за оксидной пленки, так и просто в силу своей природы. Однако при повышении температуры они вступают в реакцию с обычными соединениями, кислотами и основаниями. Эти соединения очень универсальны и широко используются. Как упоминалось ранее, физические свойства металлов сильно зависят от количества примесей. На практике хром обрабатывается с чистотой до 99,5%. Его свойства следующие.
- температура плавления – 1907 С. Эта величина служит границей между тугоплавкими и обычными веществами;
- температура кипения – 2671 С;
- твердость по шкале Мооса – 5;
- электропроводность – 9 · 106 1/(Ом•м). По этому показателю хром уступает только серебру, меди и золоту;
- удельное сопротивление –127 (Ом•мм2)/м;
- теплопроводность вещества составляет 93,7 Вт/(м•K);
- удельная теплоемкость –45 Дж/(г•K).
Теплофизические характеристики вещества несколько необычны. В Нееле, где объем металла изменяется, его коэффициент теплового расширения быстро увеличивается и продолжает расти при повышении температуры. Кроме того, теплопроводность ведет себя аномально — она падает в Нееле и уменьшается при повышении температуры.
Ионы хрома необходимы. В организме человека ионы хрома участвуют в регуляции углеводного обмена и секреции инсулина. Суточная доза составляет 50-200 микрограммов.
Хром не токсичен, но в виде металлической пыли может вызвать раздражение слизистой оболочки. Его трехлетки также относительно безопасны и используются в пищевой и спортивной промышленности. Однако атомы токсичны для человека и вызывают серьезные повреждения дыхательной и желудочно-кишечной систем.
О производстве и цене хромового металла за килограмм мы расскажем далее.
Это видео показывает, является ли покрытие Chrome.
Категории
Отсюда и применение хрома. Основным потребителем хрома является сталелитейная промышленность. Это связано со способностью металла передавать сплаву такие свойства, как устойчивость к коррозии и атрозии. Кроме того, при добавлении в очень малых количествах он приводит к.
Все хромовые сплавы делятся на две категории.
- низколегированные – с долей хрома до 1,6%. В этом случае хром добавляет стали прочности и твердости. Если у обычной стали предел прочности составит 400–580 МПа, то та же марка стали с добавкой 1% вещества продемонстрирует предел равный 1000 МПа;
- высоколегированные – содержат более 12% хрома. Здесь металл обеспечивает сплаву такую же стойкость к коррозии, какой обладает сам. Все нержавеющие стали называют хромовыми, поскольку именно этот элемент обеспечивает это качество.
Низколегированные сплавы относятся к конструкционным сталям. Они используются в производстве многочисленных двигателей, включая валы, шестерни и насосы. Применение нержавеющих сталей огромно. Металлические части турбин, кораблей и подводных лодок, камеры сгорания, связки всех видов, трубы, швеллеры, рога, стальные гранулы и т.д.
Хром также повышает термостойкость сплава: на 30 — 66%, жаропрочные изделия могут выдерживать эксплуатацию при температуре до 1200°C. Этот материал используется в поршневых двигателях, крепеже, аксессуарах для турбин и в других областях.
В то время как 70% хрома используется в металлургии, остальные 30% используются для окраски. Суть процесса заключается в нанесении тонкого слоя хрома на поверхность металлического предмета. Используются различные методы, многие из которых доступны частным лицам.
Хромирование

Окрашивание можно разделить на две категории.
- функциональное – его целью является предупредить коррозию изделия. Толщина слоя здесь больше, так что процесс хромирования занимает больше времени – порой до 24 часов. Кроме того, что хромовый слой предупредит ржавление, он заметно увеличивает износостойкость детали;
- декоративное – хром создает зеркально-блестящую поверхность. Автолюбители и мотогонщики редко когда отказываются от возможности украсить свою машину хромированными деталями. Слой декоративности покрытия намного тоньше – до 0,0005 мм.
Хромирование широко используется в современной архитектуре и производстве мебели. Аксессуары с зеркальным покрытием, аксессуары для ванной и кухни, посуда, элементы мебели — хромированные изделия пользуются большой популярностью. Однако благодаря современным методам хромирования отделка может быть использована практически на любом предмете, появляются и неформальные применения. Так, например, хромированную сантехнику нельзя назвать тривиальным решением.
Хром — это металл с очень необычными свойствами, которые востребованы в промышленности. В большинстве случаев сплавы и их соединения представляют интерес и подчеркивают важность металла в народном хозяйстве.
Голосовое управление — просто нажмите специальную кнопку и скажите, что вы хотите найти, и Chrome найдет это автоматически. Вы также можете, если я не ошибаюсь, сказать, например, погоду в Москве — и браузер может ответить в голосовом режиме.
Хром встречается в природе, в основном, в виде железа-хрома Fe (CrO)2)2 (феррохром). Феррохром производится путем восстановления в коксовых (углеродистых) электропечах.
Феррохром используется в производстве легированных сталей.
Для получения чистого хрома реакцию проводят следующим образом.
1) Плавление хромитовой руды карбонатом натрия (содой) на воздухе:.
2) Растворение хромата натрия и отделение его от оксида железа.
3) Превращение хромовой кислоты в дихромовую кислоту путем подкисления раствора и кристаллизации дихромовой кислоты.
(4) Дихромат натрия восстанавливают углеродом для получения чистого оксида хрома:.
5) Алюминотермит используется в производстве металлического хрома:.
6) Электролизированный хром получают электролизом из растворов безводной хромовой кислоты с добавлением серной кислоты. В этом процессе катоды катодируются в трех основных процессах.
- восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
Химические свойства
Характерные степени окисления
Степени окисления хрома составляют +2, + 3 и +6. (См. таблицу) Почти все соединения хрома окрашены5.
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
|---|---|---|---|---|---|
| +2 | CrO (чёрный) | Не существует | Основный | Cr 2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2o3(зелёный) | Cr(OH)3 | Амфотерный | Cr 3+ (зеленые или лиловые соли) Cr(OH)4 — (зелёный) | |
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
| +6 | CrO3(красный) | H2CrO4 H2Cr2o7 | Кислотный | CrO4 2- (хромовый, желтый) Cr2o7 2- (дихроматы, оранжевые) | Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
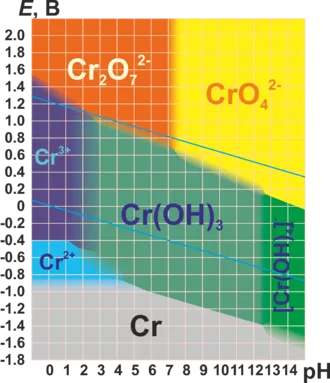

Простое вещество
Пассивный и поэтому стабилен в воздухе. По этой же причине он не реагирует с серной или азотной кислотой. Сгорает при 2000°C с образованием зеленого оксида хрома (III) Cr2o3Обладает амфотерными свойствами.
Соединения Cr(+2)
Основной оксид CrO (черный) соответствует степени окисления +2. Соли Cr 2+ (синий раствор) получают путем восстановления солей Cr3+ или дихромата цинка в кислой среде («водород при выделении»).
2Cr ^> «» «ширина =» «» высота =» «» />
Все эти соли Cr2+ являются сильными восстановителями, настолько, что вытесняют водород из воды при стоянии6. Cr 2+ окисляется кислородом воздуха, особенно в кислой среде, быстро превращая синий раствор в зеленый.
Коричневый или желтый гидроксид Cr(OH)2 OH выпадает в осадок при добавлении щелочи к растворам хрома (II).
CrF дигалогенид хрома(II)2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степень окисления +3 соответствует амфотерным оксидам Cr2o3 и гидроксиды Cr(OH)3 (оба зеленые). Это наиболее стабильное состояние окисления хрома. Соединения хрома в этом состоянии окисления имеют грязно-фиолетовый цвет (Cr(H2O)6 зеленый 3+ (резонансная сфера имеет анион).
Cr 3+ является наиболее стабильным состоянием окисления MICr(SO4)2-12H2O (глинозем).
Гидроксид хрома (III) получают действием аммиака на растворы хрома (III).
«width =» «» «height =» «» />
Можно также использовать щелочные растворы, но при этом образуются чрезмерно растворимые гидроксикомплексы.
» width=»» height=»» />
Cr в результате ядерного синтеза.2o3 используется щелочь, образуется хромит.
Неотвержденный оксид хрома (III) растворим в щелочных растворах и кислотах.
Окисление соединений хрома (III) в щелочной среде приводит к образованию соединений хрома (VI).
Применение
Хром является важным компонентом многих обрезных сталей (особенно нержавеющих) и многих других сплавов. Используется в качестве износостойкого и красивого электролитического покрытия (Chrome). Хром используется для производства сплавов Chrome-30 и Chrome-90, которые необходимы для производства мощных плазменных сопел и в аэрокосмической промышленности.
Хром является биоатомом и стабильным компонентом растительных и животных тканей. В организме животных хром участвует в метаболизме липидов, белков (часть фермента типсина) и углеводов. Снижение содержания хрома в пище и крови приводит к снижению темпов роста и повышению уровня холестерина в крови.
В чистом виде хром очень токсичен, а металлический порошок хрома раздражает легочную ткань. Соединения хрома (III) вызывают дерматит. Соединения хрома (VI) связаны с рядом заболеваний человека, включая рак. ПДК хрома (VI) в воздухе составляет 0,0015 мг/м3.
В защите нуждаются не только металлы, но и дерево. При обработке солями хрома она становится недоступной для разрушения микроорганизмами, насекомыми и, кроме того, снижается возможность механического повреждения.